铁及其化合物在生产、生活中有着广泛的应用。
I. 钢 ( 一种铁碳合金 ) 是用量最大、用途最广的合金。钢中碳的含量范围为 _______ 。
a.4.3%~5% b.2%~4.3% c.0.03%~2%
II.FeSO 4 可作补血剂,用于治疗缺铁性贫血症。用 FeSO 4 溶液制备 Fe(OH) 2 的操作是用长滴管吸取不含 O 2 的 NaOH 溶液,插入 FeSO 4 溶液液面下,再挤出 NaOH 溶液。这样操作的原因是为了防止 Fe(OH) 2 被氧化,写出其被氧化的化学反应方程式 _______ 。
III. 高铁酸钾 (K 2 FeO 4 ) 是一种新型、高效、无毒的多功能水处理剂。查阅资料已知: K 2 FeO 4 为紫色固体,微溶于 KOH 溶液,具有强氧化性,在酸性或中性溶液自身发生氧化还原生成 Fe 3+ ,并快速产生 O 2 ,在碱性溶液中较稳定。
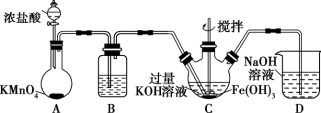
(1) 制备 K 2 FeO 4
① 在装置 A 中发生的化学反应中 HCl 显示出来的性质为 _______ 。
②C 为制备 K 2 FeO 4 装置,次氯酸钾与氢氧化铁在碱性环境中反应生成 K 2 FeO 4 ,该氧化还原反应中氧化剂与还原剂的物质的量之比为 _______ 。
(2) 探究 K 2 FeO 4 的性质
取 C 中浅紫红色溶液,加入稀硫酸,产生黄绿色气体,得溶液 a ,经检验气体中含有 Cl 2 。为证明 K 2 FeO 4 能否氧化 Cl - 而产生 Cl 2 ,设计如下方案:取少量溶液 a ,滴加 _______ 溶液至过量,溶液呈红色。由方案中溶液变红可知 a 中含有 Fe 3+ ,该离子的产生不能判断一定是由 K 2 FeO 4 被 Cl - 还原而形成的,原因是 _______ 。
(3) 使用时经常通过测定高铁酸钾的纯度来判断其是否变质。 K 2 FeO 4 在硫酸溶液中反应如下:
① 完成并配平离子方程式: _______
_______FeO +_______H + =_______Fe 3+ +_______O 2 ↑+_______H 2 O
② 现取 C 中洗涤并干燥后的样品 10g ,加入稀硫酸,收集到 0.672L 气体 ( 标准状况 ) 。则样品中高铁酸钾的质量分数为 _______ 。 ( 计算结果保留到 0.1%)
答案
c 4Fe(OH) 2 +O 2 +2H 2 O=4Fe(OH) 3 还原性、酸性 3:2 KSCN K 2 FeO 4 在酸性或中性溶液自身发生氧化还原生成 Fe 3+ 4FeO +20H + =4Fe 3+ +3O 2 ↑+10H 2 O 79.2%
【详解】
I .生铁含碳量超过 2% ,钢的含碳量小于 2% ,选 c ;
II . Fe(OH) 2 和空气中的氧气反应生成红褐色 Fe(OH) 3 ,反应的化学反应方程式是 4Fe(OH) 2 +O 2 +2H 2 O=4Fe(OH) 3 ;
III . (1) ①在装置 A 中高锰酸钾和浓盐酸反应生成氯化钾、氯化锰、氯气、水,盐酸中部分氯元素化合价升高生成氯气,部分氯元素化合价不变,所以 HCl 显示出来的性质为还原性、酸性;
②次氯酸钾与氢氧化铁在碱性环境中反应生成 K 2 FeO 4 ,次氯酸钾中氯元素化合价由 +1 降低为 -1 ,次氯酸钾是氧化剂,氢氧化铁中铁元素化合价由 +3 升高为 +6 ,氢氧化铁是还原剂,根据得失电子守恒,氧化剂与还原剂的物质的量之比为 3:2 ;
(2) Fe 3+ 遇 KSCN 溶液变红色,所以滴加 KSCN 溶液至过量,溶液呈红色,可知溶液中含有 Fe 3+ ; K 2 FeO 4 在酸性或中性溶液自身发生氧化还原生成 Fe 3+ ,并快速产生 O 2 ,所以该离子的产生不能判断一定是由 K 2 FeO 4 被 Cl - 还原而形成的;
(3) ①反应中铁元素化合价由 +6 降低为 +3 ,氧元素化合价由 -2 升高为 0 ,根据得失电子守恒、电荷守恒,反应离子方程式为 4FeO +20H + =4Fe 3+ +3O 2 ↑+10H 2 O ;
② 0.672L 气体 ( 标准状况 ) 的物质的量是 0.03mol ,根据 4FeO +20H + =4Fe 3+ +3O 2 ↑+10H 2 O ,可知高铁酸钾的物质的量是 0.04mol ,样品中高铁酸钾的质量分数为
。
【点睛】
本题以高铁酸钾的制备、性质探究、含量测定为载体,考查氧化还原反应、实验探究能力,掌握氧化还原反应规律、离子检验是解题关键,培养学生实验分析评价能力。



