工业上用铝土矿 ( 主要成份是 Al 2 O 3 ,还含有 Fe 2 O 3 、 SiO 2 ) 提取氧化铝做冶 炼铝的原料 ( 纯净的 Al 2 O 3 ) ,某研究性学习小组设计了如下提取流程:
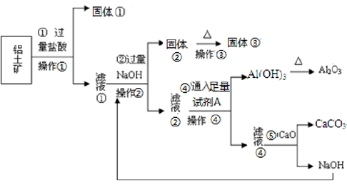
请回答下列问题:
(1) 操作 ①的名称是 ___________ ,操作 ③用到的仪器有酒精灯、三脚架、泥三角 ____________ 。
(2) 固体 ②的颜色为 ___________ 。
(3) 流程 ④中生成 Al(OH) 3 的离子方程式是 ___________ 。
(4) 上述流程不涉及的化学反应类型是 ___________ 。
A .复分解反应 B .氧化还原反应 C .化合反应 D .分解反应
(5) 用固体 ①制备硅酸,涉及的化学反应方程式为 ___________ 、 ___________ 。
(6) 有一种含铁、硅等元素的矿石,其主要成分的化学式为 Na 2 Fe 5 (OH) 2 Si 8 O 22 ,该物质中 +2 价铁与 +3 价铁的物质的量之比为 ___________ 。将 mg 该矿石用足量的酸溶解后,加入过量铜粉使溶液中的铁元素全部变为 Fe 2+ ,过滤后滤液用 c mol/L 的 KMnO 4 酸性溶液与 Fe 2+ 反应,用去 VmL 溶液。该矿石中铁元素的质量分数为 ____________ ( 用含 m 、 c 、 V 的代数式表示 ) 。
答案
过滤 坩埚(坩埚钳) 红褐色 AlO + CO 2 + 2H 2 O = Al(OH) 3 ↓ + HCO
B SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O Na 2 SiO 3 + 2HCl= 2NaCl+ H 2 SiO 3 ↓ 3:2
【分析】
铝土矿的主要成分为 Al 2 O 3 ,还含有 Fe 2 O 3 、 SiO 2 ,铝土矿中加入过量盐酸溶解后, Al 2 O 3 、 Fe 2 O 3 和 HCl 反应溶解,而 SiO 2 和 HCl 不反应,不能溶解,则固体 ①为 SiO 2 ;滤液 ①中含有 AlCl 3 、 FeCl 3 、 HCl ,加入过量 NaOH , HCl 和 NaOH 反应生成水和 NaCl , AlCl 3 、 FeCl 3 都和氢氧化钠反应生成氢氧化物沉淀和 NaCl ,氢氧化铝易溶于 NaOH 溶液中生成 NaAlO 2 和水,过滤所得的固体 ②为 Fe(OH) 3 ,加热分解生成固体 ③为 Fe 2 O 3 ,滤液 ②中含有 NaAlO 2 、 NaOH 、 NaCl ;在滤液 ②中通入过量二氧化碳气体,得到 Al(OH) 3 沉淀,加热分解生成 Al 2 O 3 ,滤液 ④中含有 NaHCO 3 、 NaCl ,加入 CaO , CaO 与水反应生成 Ca(OH) 2 , Ca(OH) 2 与 NaHCO 3 反应生成 CaCO 3 和 NaOH ,其中 NaOH 可循环使用,以此解答该题。
【详解】
(1) 操作 ①的名称是过滤;操作③为加热分解 Fe(OH) 3 固体,用到的仪器有酒精灯、三脚架、泥三角,还有坩埚 ( 坩埚钳 ) ;
(2) 由分析知,固体 ②为 Fe(OH) 3 ,颜色为红褐色;
(3) 流程 ④中生成 Al(OH) 3 的离子方程式是 AlO + CO 2 + 2H 2 O = Al(OH) 3 ↓ + HCO
;
(4) 反应 ①②④⑤为复分解反应,反应③为分解反应,氢氧化铝加热生成氧化铝是分解反应,不涉及氧化还原反应;
(5) 用 SiO 2 制备硅酸,涉及的化学反应方程式为 SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O
、 Na 2 SiO 3 + 2HCl= 2NaCl+ H 2 SiO 3 ↓ ;
(6) 设该物质的化学式中 +2 价铁有 x 个, +3 价铁有 y 个,则根据铁原子守恒得: x+y=5 ,根据化合价代数和为 0 得: 1×2+2x+3y+4×8=1×2+2×22 ,解得: x=3 , y=2 ,则该物质中 +2 价铁与 +3 价铁的物质的量之比为 3 : 2 ; KMnO 4 与 Fe 2+ 反应的离子方程式为 ,则可得关系式
,则 Fe 2+ 物质的量为
,则该矿石中铁元素的质量分数为
。



 N2+3Cu+3H2O
N2+3Cu+3H2O